- RÉGULATIONS BIOCHIMIQUES
- RÉGULATIONS BIOCHIMIQUESOn désigne sous le nom de régulation génétique l’ensemble des mécanismes capables de moduler l’expression du potentiel héréditaire dans une cellule vivante en fonction des signaux qu’elle reçoit, en provenance d’autres cellules ou de l’environnement. Concrètement, le contenu génétique de la cellule, constitué d’acides nucléiques, s’exprimera sous forme de protéines dont la synthèse est donc biochimiquement programmée, selon des modalités dont l’analyse fait l’objet de la biologie moléculaire [cf. BIOLOGIE MOLÉCULAIRE].Il suffira de rappeler ici que les protéines sont constituées d’acides aminés (dont il existe vingt espèces différentes) unis linéairement entre eux. Les protéines se distinguent les unes des autres par le nombre et l’ordre d’enchaînement ou séquence des acides aminés. Cette séquence déterminera la fonction de ces protéines; certaines seront des enzymes, d’autres des anticorps, des hormones, des matériaux de structure cellulaire, etc. Il importe donc que l’ordre d’assemblage des acides aminés au cours de la synthèse des protéines soit rigoureusement défini.Le code qui régit l’enchaînement séquentiel des acides aminés est détenu par l’acide désoxyribonucléique ou ADN. Cette molécule jouant un rôle informationnel constitue le matériel génétique cellulaire. Macromolécule bicaténaire, c’est-à-dire formée de deux chaînes complémentaires, ou brins, appariées entre elles, l’ADN est composé d’unités, les nucléotides, de quatre sortes (A = adénine, G = guanine, C = cytosine et T = thymine), liées d’une chaîne à l’autre par couplage T-A ou G-C. La séquence des nucléotides d’un brin est spécifique, de telle sorte qu’elle représente une succession de segments, les gènes ; chacun d’eux est capable de coder la biosynthèse d’une protéine (ou d’une sous-unité de celle-ci).Cependant, une protéine n’est pas synthétisée directement au contact de l’ADN. Sur l’un des brins de celui-ci prend naissance une molécule d’acide ribonucléique ou ARN messager, qui copie la séquence nucléotidique du gène correspondant, selon un mécanisme qualifié de transcription . L’ARN messager est donc porteur d’une information génétique calquée sur celle de l’ADN; elle est constituée d’une suite de triplets nucléotidiques appelés codons, signaux biochimiques correspondant aux divers acides aminés. Le système de correspondance a reçu le nom de code génétique . La lecture du code génétique s’opère au cours de la biosynthèse des protéines, au niveau d’une petite particule cytoplasmique nommée ribosome. C’est là que l’information contenue dans l’ARN messager est traduite en séquence d’acides aminés d’une protéine.La traduction ribosomale fait intervenir une machinerie biochimique complexe: elle comporte notamment des molécules d’ARN de transfert, spécifiques des différents acides aminés.Porté par son ARN de transfert, un acide aminé sera intégré au ribosome au moment précis où celui-ci, en se déplaçant sur l’ARN messager, sera présent sur le codon correspondant. L’adaptation de l’ARN de transfert sera assurée par l’anticodon, séquence nucléotidique complémentaire du codon, qui le caractérise. Le patrimoine génétique défini par la composition séquentielle de l’ADN va donc, en définitive, s’exprimer par un certain équipement protéique.Mais cet équipement se modifie au cours de la vie (d’une cellule ou d’un organisme), ce qui montre que le patrimoine génétique est aussi un programme de biosynthèse . Comment la nature des protéines produites peut-elle varier en fonction des étapes de la vie? Comment leur rôle peut-il être adapté aux besoins temporaires du travail cellulaire? Tels sont les deux problèmes majeurs auxquels l’on se proposera de répondre.Une substance biologique, un substrat ou métabolite, peut être amené à subir des transformations métaboliques variées. Il est donc essentiel que des mécanismes régulateurs soient présents dans la cellule et dans l’organisme, qui activent certaines voies métaboliques et inhibent les autres voies, de sorte que la substance subit les transformations utiles à la vie cellulaire à un moment donné. Le cas le plus caractéristique est celui d’un composé qui peut soit se dégrader en produisant de l’énergie, soit au contraire être mis en réserve par un mécanisme qui, en revanche, consommera de l’énergie. Le glucose alimentaire représente l’exemple le plus évident. Il peut, dans le muscle, être dégradé en fournissant l’énergie nécessaire à la contraction musculaire, ou bien être transformé en glycogène, qui ne se dégradera que lorsqu’il existera un besoin énergétique.Cet ajustement métabolique fait nécessairement intervenir des signaux indiquant aux enzymes l’état énergétique de la cellule. Si les signaux indiquent que la cellule est carencée en énergie, les enzymes de dégradation seront actives et les enzymes impliquées dans la mise en réserve seront inhibées; le processus sera inversé si la cellule a un niveau énergétique élevé.Les transferts d’énergie mettent en jeu une molécule essentielle, l’adénosine triphosphate ou ATP. Cette molécule se dégrade en adénosine di- ou monophosphate en perdant un phosphate ou un pyrophosphate et en fournissant l’énergie nécessaire aux synthèses biochimiques, à l’exercice musculaire, à la pénétration de molécules dans la cellule.On peut schématiser l’hydrolyse de l’ATP de la façon suivante:
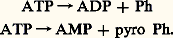 L’ADP pénètre dans les mitochondries cellulaires pour reformer l’ATP grâce à l’énergie produite par les oxydations. L’ATP sort ensuite des mitochondries (fig. 1). L’ATP est un signal important de charge énergétique élevée de la cellule; l’ADP, l’AMP sont des signaux de charge énergétique basse. Le rapport ATP/ADP + Ph contrôle l’intensité de la respiration. Un rapport élevé ralentit la respiration, un rapport bas l’active.Si la respiration est ralentie, un transporteur d’hydrogène, NAD, sera présent sous forme réduite NADH2. Si la respiration est active, il cédera au contraire son hydrogène et sera présent sous forme NAD. NADH2 est un témoin de charge énergétique élevée, NAD un témoin de charge énergétique basse.Il existe dans les principales voies métaboliques une ou plusieurs étapes catalysées par une enzyme régulatrice. Ces enzymes régulatrices, qui sont généralement allostériques, sont précisément les enzymes sur lesquelles agissent les signaux. Ces signaux activeront ou inhiberont ces enzymes et ainsi canaliseront les métabolites vers les voies satisfaisantes pour les besoins de la cellule. Cependant, les besoins énergétiques de la cellule ne sont pas les seuls indicateurs des voies métaboliques. Une abondance excessive en un composé ou au contraire une carence en un composé important pourront fournir le signal qui corrigera les métabolismes, de sorte que le composé en excès disparaîtra, ou ne sera plus synthétisé, ou au contraire un composé déficient sera activement synthétisé.Les organismes animaux disposent d’un second type de contrôle sur les métabolismes; celui-ci est réalisé par les hormones, dont la diffusion dans le milieu intérieur permet de coordonner les métabolismes dans l’ensemble des cellules cibles; les hormones agissent sur les enzymes, par un mécanisme non allostérique, en modifiant leur activité ou leur quantité.1. Régulation génétiqueLe modèle bactérienDepuis 1961 ont été décrits les principaux mécanismes de la régulation génétique chez les bactéries. Le contrôle s’exerce essentiellement au niveau de la transcription grâce à des gènes qui exercent un rôle régulateur sur les gènes codants, rôle qui dépend des signaux reçus de l’extérieur. Deux exemples montrent la nature de la régulation. Un sucre, le lactose, est un aliment pour une bactérie, Escherichia coli . L’utilisation de ce sucre nécessite trois enzymes. Si le milieu sur lequel pousse la bactérie est dépourvu de lactose, on ne trouve que des traces de ces enzymes dans la cellule bactérienne. Cela est dû au fait qu’une protéine régulatrice appelée répresseur se combine à un gène opérateur , et que, du fait de cette liaison, les gènes sur lesquels sont synthétisés les ARN messagers des trois enzymes sont mis hors circuit: le système en cause a été dénommé opéron. Si l’on ajoute du lactose dans le milieu, la liaison du répresseur au gène opérateur ne se fait plus, ce qui déclenche la formation des ARN messagers qui seront alors traduits en enzymes: ce phénomène est appelé induction enzymatique .Il existe un contrôle supplémentaire. L’utilisation du lactose n’a de sens que si la bactérie est carencée en énergie. Cette carence va se manifester par la production d’AMP cyclique. Ce composé, qui chez les animaux joue un rôle d’intermédiaire de nombreuses hormones, sera, chez les bactéries, un signal de carence. L’AMP cyclique se combine à une protéine de liaison particulière et le complexe se lie à un gène, le gène promoteur , qui coopère avec le gène opérateur. Donc, pour que la synthèse des ARN messagers des trois enzymes ait lieu, il faut d’une part la présence de lactose dans le milieu, d’autre part un besoin énergétique au sein de la cellule bactérienne.Un autre mode de régulation intervient aussi chez les bactéries. Si l’on ajoute au milieu un acide aminé, l’histidine par exemple, la bactérie cesse de synthétiser elle-même cet acide aminé. Cela est dû au fait que l’acide aminé exogène favorise la fixation d’un répresseur sur un gène opérateur qui régit la synthèse de cet acide aminé. Cela bloque la formation des ARN messagers des enzymes intervenant dans la synthèse de l’histidine. Il s’agit donc ici d’un phénomène appelé répression. Ces divers exemples montrent donc clairement que chez les bactéries l’essentiel de la régulation génétique se fait au niveau de la transcription.Le cas des cellules eucaryotesLes cellules animales et végétales eucaryotes se distinguent par au moins deux caractères de la cellule bactérienne:– Ces cellules ont un noyau dans lequel l’ADN est enfermé; il est donc séparé du cytoplasme malgré les échanges nombreux qui peuvent s’effectuer à travers la double membrane qui entoure ce noyau. La transcription ne pourra donc pas être influencée simplement par le milieu extérieur.– Ces cellules sont différenciées , ce qui signifie qu’elles sont spécialisées dans une ou un petit nombre de fonctions. Chaque cellule ne synthétise donc pas l’ensemble des protéines que renferme l’organisme entier: ainsi l’hémoglobine est synthétisée dans les cellules de la moelle osseuse, mais la plupart des protéines du plasma sanguin se forment dans les cellules du foie. Cependant, toute vie cellulaire met en jeu un certain nombre de protéines, d’enzymes, qui doivent être synthétisées par toutes les cellules.La régulation génétique doit donc s’exercer à deux niveaux: détermination et activation.Premier niveau, la détermination . On avait pensé que l’ADN se répartissait de manière inégale au cours de la différenciation, chaque cellule recevant seulement les gènes dont elle a besoin. L’expérience de J. Gurdon a montré que ce n’était pas le cas. Cet embryologiste remplace les noyaux d’œufs de crapaud par des noyaux provenant de cellules hautement différenciées de cet animal adulte. Il constate qu’un certain nombre d’œufs se développent et donnent naissance à des crapauds complètement normaux. L’ADN des cellules différenciées contient donc la totalité des gènes de l’organisme. Mais, dans chaque type de cellule différenciée, certains gènes seront mis sous une forme particulière qui permettra leur expression après réception d’un signal. La nature de ces gènes varie avec la nature de la cellule différenciée.Second niveau, l’activation des gènes. Les gènes destinés à s’exprimer dans une cellule donnée ne le font pas en permanence. Ils devront recevoir à cet effet un signal qui peut être hormonal ou d’une autre nature. Par ailleurs, la régulation génétique dans les cellules eucaryotes ne se fait pas exclusivement au niveau de la transcription, mais à plusieurs niveaux successifs. On peut étudier ces régulations grâce aux anomalies susceptibles de se produire au cours de certaines circonstances pathologiques. Nous en donnerons deux exemples.L’hémoglobine synthétisée par le fœtus est différente de l’hémoglobine adulte; cependant, lors d’une maladie du sang, la thalassémie, on observe une synthèse d’hémoglobine fœtale chez l’adulte (il en est de même après de fortes hémorragies).Les cellules cancéreuses synthétisent des protéines et des enzymes qui normalement ne sont synthétisées que chez le fœtus: ce sont les protéines carcino-embryonnaires. Dans ces deux cas, il y a bien eu modification pathologique du programme de l’expression génétique.Structure de l’ADN des eucaryotesL’ADN est une molécule très longue; chez l’homme, l’ADN a plus de 1 mètre de long dans chaque cellule. On peut couper la molécule en fragments et comparer ceux-ci. On constate que ces fragments d’ADN peuvent se grouper en trois catégories:– des fragments hautement répétitifs, petits fragments d’ADN identiques à eux-mêmes présents dans la molécule en un très grand nombre d’exemplaires, de l’ordre du million; leur signification est inconnue;– des fragments moyennement répétitifs, fragments identiques à eux-mêmes et présents en quelques centaines ou quelques milliers d’exemplaires: deux catégories sont à distinguer. Le premier groupe comprend les gènes qui codent pour les ARN des ribosomes, les ARN de transfert (qui sont présents en plusieurs centaines d’exemplaires). Le second groupe comprend des fragments dispersés tout le long de l’ADN et qui, pense-t-on généralement, jouent un rôle régulateur vis-à-vis des gènes adjacents (rôle peut-être analogue à celui des gènes régulateurs des bactéries);– des fragments non répétés ou répétés un très petit nombre de fois; ils correspondent aux gènes qui codent pour les protéines.Les travaux (1981) de P. Chambon et de Flavell ont montré qu’un gène codant pour une protéine pouvait être en fait scindé en plusieurs fragments non adjacents, les exons , séparés par des fragments non codants, les introns . Ainsi le gène codant pour l’ovalbumine, protéine du blanc d’œuf, est formé de 13 fragments adjacents: 7 exons séparés par 6 introns. Les exons ne représentent que le tiers du gène total. Le gène codant pour une chaîne d’hémoglobine est formé de 5 parties adjacentes, 3 exons séparés par 2 introns. Il est possible que les introns interviennent soit au cours de la différenciation, soit lors du contrôle de l’expression des parties codantes voisines.La chromatineL’ADN n’est pas libre dans la cellule eucaryote. Dans les bactéries, il est combiné à une protéine, la protéine HU. Dans les cellules eucaryotes, l’ADN est combiné à de nombreuses protéines différentes; celles-ci sont importantes car elles interviennent dans la structuration spatiale de l’ADN et dans le contrôle de l’expression génétique. On appelle du nom déjà ancien de chromatine l’ADN et les protéines qui lui sont associées. Ces protéines appartiennent à 2 classes très différentes: histones et non histones.HistonesCes protéines sont de 5 types; ce sont des molécules basiques qui ont tendance à se combiner entre elles et à se combiner à l’ADN. En 1974-1975, plusieurs laboratoires ont établi que la chromatine était formée de subunités, les nucléosomes , composées de 4 types d’histones, présentes chacune à raison de 2 molécules et formant un disque compact. Ce disque est entouré d’un fragment d’ADN qui comprend 140 paires de nucléotides. L’ADN se continue d’une courte longueur, 20-80 paires de nucléotides, puis forme un nouveau nucléosome. On a une structure en perles, excepté que le fil, ici l’ADN, entoure les perles au lieu de les traverser. Un cinquième type d’histone est localisé en dehors de la structure nucléosomique. Les gènes font partie de la structure nucléosomique. Cependant, dans une cellule donnée, les gènes qui s’expriment ou qui sont destinés à s’exprimer à un moment donné de la vie de cette cellule sont dans un état particulier qui les rend accessibles aux enzymes de transcription.Les histones étant des constituants quasi universels des cellules, elles ne peuvent donc jouer un rôle régulateur direct. Cependant, ces protéines peuvent fixer, à l’aide d’enzymes présents dans la chromatine, des radicaux phosphates et acétyles. Des travaux récents montrent que la fixation de phosphate sur une histone, réaction catalysée par une enzyme, l’histone-kinase, est le facteur déclenchant de la division cellulaire (mitose) et que la fixation d’acétyle sur des histones serait un des signaux d’activation des gènes. Ainsi ces modifications des histones (appelées postsynthétiques car elles se produisent sur des histones déjà synthétisées) jouent un rôle régulateur important sur la prolifération cellulaire et sur l’expression génétique.Protéines non histonesLes protéines non histones forment la deuxième classe des protéines de la chromatine. Ce groupe est très hétérogène, il comprend plusieurs dizaines ou centaines de protéines différentes. On peut caractériser plusieurs groupes selon leur nature ou leur fonction:– Les enzymes qui permettent la synthèse de l’ADN, la transcription, les modifications postsynthétiques des histones.– Les récepteurs d’hormones: les hormones stéroïdes (hormones génitales mâles et femelles, hormones de la corticosurrénale) et l’hormone thyroïdienne ont été bien étudiées. Après leur sécrétion, les hormones stéroïdes se répandent dans toutes les cellules, mais seules les cellules sensibles, ou cellules cibles, à l’une de ces hormones possèdent dans leur cytoplasme ou leurs noyaux une protéine, le récepteur, qui fixera avec une forte affinité cette hormone; le complexe hormone-récepteur se liera à la chromatine. Le récepteur constitue alors une protéine non histone. La fixation du complexe se fera sur un site ou des sites bien définis de la chromatine et déclenchera la synthèse d’un ou d’un petit nombre d’ARN messagers. La nature du récepteur, le site de fixation sur la chromatine et la nature des ARN messagers synthétisés varient d’une hormone à l’autre et d’un type de cellule à l’autre. Ainsi, par ce mécanisme, les hormones stéroïdes exercent un effet régulateur sur l’expression génétique. L’hormone thyroïdienne agit également au niveau de la chromatine, mais son mécanisme d’action est différent. Cette hormone pénètre à l’état libre dans le noyau et elle se fixe sur un récepteur déjà présent dans la chromatine, parmi les protéines non histones. Cette fixation modifie les propriétés du récepteur et déclenche une série de phénomènes au niveau génétique, phénomènes qui diffèrent considérablement selon le type de cellule envisagé.– Des protéines contractiles ou liées à des mouvements intracellulaires, comme l’actine, la myosine interviennent dans la cytodiérèse; la tubuline joue probablement un rôle dans les mouvements de chromosomes qui se produisent au cours de la mitose.– Les protéines liées à l’ARN prémessager. Ce sont des constituants de la chromatine qui vont quitter celle-ci pour accompagner les ARN après leur synthèse.– Les protéines régulatrices, proprement dites, qui sont les moins connues quoique vraisemblablement les plus importantes. Cette régulation peut être assurée par la liaison de ces protéines, ou peut-être par des transformations postsynthétiques, comme des phosphorylations, car on a montré que la nature des phosphorylations des protéines non histones se modifie au cours de la croissance de la cellule et au cours de la différenciation. Parmi les protéines régulatrices, un groupe semble jouer un rôle important, le groupe HMG (high mobility group ). Ces protéines seraient responsables, par le site de leur liaison, de la détermination dans chaque cellule des gènes qui pourront être exprimés au cours de la vie de cette cellule: elles placeraient ces gènes dans un état leur permettant de recevoir le signal de fonctionnement.Transcription et maturationPour s’exprimer, un gène doit être transcrit en ARN. La transcription est catalysée par des enzymes, les ARN-polymérases. Celles-ci sont au nombre de trois:– l’ARN-polymérase I ou A, qui permet la synthèse des ARN des ribosomes dans des formations spéciales, les nucléoles;– l’ARN-polymérase II ou B, qui est responsable de la synthèse des ARN messagers;– l’ARN-polymérase III ou C, qui permet la synthèse des ARN de transfert et des petits ARN des ribosomes.Il est remarquable que les ARN qui sont synthétisés sont plus longs que les ARN définitifs; ils vont subir des modifications que l’on appelle maturation . La maturation consiste essentiellement en l’élimination de certaines parties de la molécule, mais également en quelques additions. Il est vraisemblable que la maturation, qui met en jeu des enzymes spécifiques, joue un rôle régulateur. On a en effet montré qu’il existait, dans le noyau, des précurseurs d’ARN messagers qui ne donneront jamais naissance à des ARN messagers fonctionnels. Tout se passe comme si, dans une cellule donnée, un trop grand nombre de gènes était transcrit et que, dans un second temps, au cours de la maturation, une seconde sélection s’opérait et que certains prémessagers étaient détruits. Ainsi la sélection des gènes qui seront exprimés dans une cellule donnée ne se fait pas seulement au niveau de la transcription, mais également lors d’étapes ultérieures par un processus séquentiel.Pour étudier la maturation des ARN, prenons l’exemple des ARN messagers. L’unité de transcription comprend le gène en entier avec les introns et les exons, ainsi que des segments antérieurs et postérieurs. Il en résulte un prémessager très long. Cet ARN va subir des coupures; les principales vont permettre d’éliminer les introns (parties non codantes du gène) du produit de transcription. Après l’élimination des introns, les exons se combinent entre eux de manière à avoir un ARN codant continu. Cependant, il reste sur cet ARN une partie antérieure et une partie postérieure non codantes, qui persisteront en partie dans l’ARN messager définitif. Une enzyme va intervenir ensuite, la poly A polymérase, qui va fixer sur la partie postérieure de l’ARN messager un fragment d’ARN formé de plusieurs dizaines de nucléotides d’un seul type (à adénine A) donnant des ARN messagers qui sont terminés par un segment poly A. Au début de la partie antérieure de l’ARN se fixe également un nucléotide particulier que l’on appelle le chapeau.Les parties non codantes, le poly A, le chapeau font partie de l’ARN messager définitif; comme les ARN prémessagers et les ARN messagers ne sont jamais libres mais combinés à des protéines qui proviennent de la chromatine, on a donc en fait des particules prémessagères qui comprennent les enzymes intervenant dans la maturation et qui peuvent recevoir des signaux régulateurs.Ainsi un ARN messager contient non seulement le code d’une protéine, mais également des informations permettant le contrôle de la synthèse de cette protéine.Régulation de la transcriptionNous avons vu que chez les bactéries la régulation de l’expression des gènes, c’est-à-dire de la synthèse protéique, se fait essentiellement au niveau de la transcription. C’est également en grande partie vrai chez les eucaryotes.On trouve dans l’ADN des eucaryotes, à environ 30 nucléotides en amont de la région codante de chaque gène, une séquence TATA , appelée boîte TATA, qui est le point de départ de l’ARN polymérase qui transcrit le gène. Il existe de plus, à des distances variables, mais parfois assez grandes, en amont ou en aval des gènes, des séquences d’ADN, appelées séquences stimulatrices . Ces séquences sont responsables de la transcription ou de la non-transcription du gène, et peut-être du niveau quantitatif de la transcription. Le fonctionnement de ces séquences dépend de la combinaison de protéines chromatiniennes présentes en très faible quantité et présentant un très haut niveau de spécificité. D’autres mécanismes peuvent également intervenir. Ainsi, la méthylation d’une des bases de l’ADN, la cytosine. Cette méthylation aura pour effet de supprimer ou de réduire la transcription du gène qui contiendra cette cytosine méthylée.L’amplification d’un gène peut jouer un rôle important. Certains facteurs, lorsqu’ils pénètrent dans la cellule, vont provoquer la réplication d’un gène qui, au lieu d’être présent en un seul exemplaire dans la cellule, sera présent en plusieurs centaines d’exemplaires, d’où une majoration du taux de transcription.Enfin, un autre mécanisme joue un rôle important dans la détermination de la concentration d’un ARN messager défini. Ce mécanisme, de nature encore inconnue, mais contrôlé génétiquement, porte sur la durée de demi-vie de l’ARN messager. Ainsi, la demi-vie d’un ARN peut être considérablement augmentée, ce qui aura pour conséquence d’augmenter sa quantité, donc celle de la protéine dont il contient le code.Traduction du message génétiqueLa synthèse protéique a lieu sur les ribosomes. L’ARN messager se fixe sur un ribosome ; il est parcouru par le ribosome de telle sorte que l’acide aminé qui correspond au trinucléotide codant présent sur le ribosome vienne se fixer, porté par le tARN auquel il est combiné. Chaque type de tARN est spécifique d’un type d’acide aminé d’une part et du trinucléotide qui contient le code de l’acide aminé d’autre part. Il s’ensuit que, si l’un de ces tARN n’est présent qu’en faible quantité, il limitera la vitesse de synthèse de la protéine, et des variations du taux du tARN, qui peuvent être commandées par des hormones, influeront sur cette vitesse de synthèse. Ainsi l’injection d’hormone sexuelle féminine à des poules augmente la synthèse par le foie du tARN porteur de l’acide aminé sérine. Or cette hormone provoque la synthèse par le foie de la phosvitine, protéine du jaune d’œuf très riche en sérine. Cette synthèse n’aurait pu s’effectuer rapidement si l’augmentation de tARN spécifique de la sérine ne s’était pas produite.Le ribosome est une particule complexe car elle contient nécessairement deux sites, un site qui reçoit le complexe acide aminé-tARN et un site qui porte le début de la protéine déjà formée. La synthèse protéique, ou traduction du message génétique au niveau de cet organite, comprend trois étapes successives.– L’initiation . Cette première étape inclut deux phénomènes: la liaison de l’ARN messager au ribosome; la fixation du premier acide aminé-tARN sur le ribosome. C’est donc le point de départ de la synthèse; elle est d’une extrême complexité et fait intervenir de nombreux facteurs dont sept au moins sont présents dans les ribosomes. L’existence de ces facteurs d’initiation rend possible une régulation complexe.– L’élongation de la chaîne polypeptidique, formée par adjonction d’acides aminés, est due à la progression du ribosome le long de l’ARN messager. À chaque mouvement, un acide aminé-tARN vient se fixer sur le ribosome, et, au mouvement suivant, l’acide aminé se fixe sur la chaîne protéique déjà synthétisée et qui est présente sur un autre site du ribosome. Lorsque le ribosome a entièrement parcouru l’ARN messager, la synthèse de la protéine est terminée. En réalité, plusieurs ribosomes parcourent en même temps un même ARN messager, ce qui fait que plusieurs molécules d’une protéine donnée sont synthétisées en même temps sur un même ARN messager. L’ensemble formé par plusieurs ribosomes combinés à un même ARN messager est appelé polysome .– Terminaison de la synthèse et libération de la protéine. Elle est sous le contrôle d’un facteur spécial, qui reconnaît sur l’ARN messager un signal indiquant la terminaison de la protéine, et qui libère la protéine terminée en la détachant du ribosome.Méthodes d’étude de l’expression des gènesUtilisation de cellules hybridesOn peut fusionner deux cellules de type différent par addition de polyéthylène glycol, on obtient un hétérocaryon avec 2 noyaux. Si on fusionne une cellule musculaire et une cellule non musculaire, on constate que le noyau de la cellule non musculaire synthétise des ARN messagers de protéines spécifiques de la cellule musculaire. On en conclut que des facteurs – très vraisemblablement protéiques – provenant de la partie musculaire de l’hétérocaryon ont stimulé des gènes auparavant silencieux du noyau non musculaire en agissant sur les séquences stimulatrices de ces gènes.TransfectionLes techniques de clonage permettent de préparer l’ADN correspondant à un gène unique. On peut faire pénétrer cet ADN dans des cellules pour y déterminer la synthèse par ces cellules de protéines correspondant à cet ADN. On peut injecter de l’ADN à des cellules germinales de souris, réimplanter ces cellules chez la mère et obtenir des animaux qui ont intégré l’ADN injecté dans leur patrimoine génétique. On a ainsi obtenu des animaux géants en injectant dans les cellules germinales de l’ADN codant pour de l’hormone de croissance. On a observé que si l’on injecte de l’ADN comportant non seulement la partie codante mais également les régions adjacentes qui comprennent les séquences régulatrices, l’ADN injecté ne s’exprime que dans les tissus dont il est spécifique. Les séquences adjacentes permettent donc de contrôler l’expression des gènes uniquement dans les cellules où ces gènes doivent provoquer la synthèse de protéines.Infection viraleOn peut fixer des gènes eucaryotes dans des virus. Lorsqu’on infecte des cellules avec ces virus, l’ADN viral peut s’incorporer dans l’ADN cellulaire et s’y exprimer. Cela est à la base de la thérapeutique génique que l’on est en train de mettre au point. On sait que la plupart des maladies héréditaires sont dues à des anomalies d’un gène qui s’exprime mal ou ne s’exprime pas. Si l’on infecte le malade avec un virus contenant le gène normal, on peut espérer corriger l’anomalie, ce qui est d’un intérêt considérable, à partir du moment où, par ailleurs, ces maladies ne relèvent que de thérapeutiques palliatives.2. Régulation métaboliqueMécanismes générauxMécanismes enzymatiques allostériquesLes enzymes allostériques sont des enzymes dont la cinétique peut être modifiée réversiblement par des composés dont la structure est éloignée de celle des substrats. Il existe des inhibiteurs et des activateurs allostériques. Lorsqu’une enzyme allostérique appartient à une chaîne métabolique, il arrive fréquemment que le produit terminal de la chaîne soit un inhibiteur allostérique de la première enzyme de celle-ci, ce qui évite une accumulation de ce produit final. Les témoins de charge énergétique sont des effecteurs allostériques, inhibant certaines enzymes, en activant d’autres, selon la logique des besoins cellulaires.Les enzymes allostériques sont toujours formées d’un nombre pair de sous-unités, l’ensemble possédant un axe de symétrie. Il existe un état actif appelé R et un état inactif T. Les deux formes sont en équilibre. Cet équilibre est déplacé par les activateurs et les inhibiteurs.
L’ADP pénètre dans les mitochondries cellulaires pour reformer l’ATP grâce à l’énergie produite par les oxydations. L’ATP sort ensuite des mitochondries (fig. 1). L’ATP est un signal important de charge énergétique élevée de la cellule; l’ADP, l’AMP sont des signaux de charge énergétique basse. Le rapport ATP/ADP + Ph contrôle l’intensité de la respiration. Un rapport élevé ralentit la respiration, un rapport bas l’active.Si la respiration est ralentie, un transporteur d’hydrogène, NAD, sera présent sous forme réduite NADH2. Si la respiration est active, il cédera au contraire son hydrogène et sera présent sous forme NAD. NADH2 est un témoin de charge énergétique élevée, NAD un témoin de charge énergétique basse.Il existe dans les principales voies métaboliques une ou plusieurs étapes catalysées par une enzyme régulatrice. Ces enzymes régulatrices, qui sont généralement allostériques, sont précisément les enzymes sur lesquelles agissent les signaux. Ces signaux activeront ou inhiberont ces enzymes et ainsi canaliseront les métabolites vers les voies satisfaisantes pour les besoins de la cellule. Cependant, les besoins énergétiques de la cellule ne sont pas les seuls indicateurs des voies métaboliques. Une abondance excessive en un composé ou au contraire une carence en un composé important pourront fournir le signal qui corrigera les métabolismes, de sorte que le composé en excès disparaîtra, ou ne sera plus synthétisé, ou au contraire un composé déficient sera activement synthétisé.Les organismes animaux disposent d’un second type de contrôle sur les métabolismes; celui-ci est réalisé par les hormones, dont la diffusion dans le milieu intérieur permet de coordonner les métabolismes dans l’ensemble des cellules cibles; les hormones agissent sur les enzymes, par un mécanisme non allostérique, en modifiant leur activité ou leur quantité.1. Régulation génétiqueLe modèle bactérienDepuis 1961 ont été décrits les principaux mécanismes de la régulation génétique chez les bactéries. Le contrôle s’exerce essentiellement au niveau de la transcription grâce à des gènes qui exercent un rôle régulateur sur les gènes codants, rôle qui dépend des signaux reçus de l’extérieur. Deux exemples montrent la nature de la régulation. Un sucre, le lactose, est un aliment pour une bactérie, Escherichia coli . L’utilisation de ce sucre nécessite trois enzymes. Si le milieu sur lequel pousse la bactérie est dépourvu de lactose, on ne trouve que des traces de ces enzymes dans la cellule bactérienne. Cela est dû au fait qu’une protéine régulatrice appelée répresseur se combine à un gène opérateur , et que, du fait de cette liaison, les gènes sur lesquels sont synthétisés les ARN messagers des trois enzymes sont mis hors circuit: le système en cause a été dénommé opéron. Si l’on ajoute du lactose dans le milieu, la liaison du répresseur au gène opérateur ne se fait plus, ce qui déclenche la formation des ARN messagers qui seront alors traduits en enzymes: ce phénomène est appelé induction enzymatique .Il existe un contrôle supplémentaire. L’utilisation du lactose n’a de sens que si la bactérie est carencée en énergie. Cette carence va se manifester par la production d’AMP cyclique. Ce composé, qui chez les animaux joue un rôle d’intermédiaire de nombreuses hormones, sera, chez les bactéries, un signal de carence. L’AMP cyclique se combine à une protéine de liaison particulière et le complexe se lie à un gène, le gène promoteur , qui coopère avec le gène opérateur. Donc, pour que la synthèse des ARN messagers des trois enzymes ait lieu, il faut d’une part la présence de lactose dans le milieu, d’autre part un besoin énergétique au sein de la cellule bactérienne.Un autre mode de régulation intervient aussi chez les bactéries. Si l’on ajoute au milieu un acide aminé, l’histidine par exemple, la bactérie cesse de synthétiser elle-même cet acide aminé. Cela est dû au fait que l’acide aminé exogène favorise la fixation d’un répresseur sur un gène opérateur qui régit la synthèse de cet acide aminé. Cela bloque la formation des ARN messagers des enzymes intervenant dans la synthèse de l’histidine. Il s’agit donc ici d’un phénomène appelé répression. Ces divers exemples montrent donc clairement que chez les bactéries l’essentiel de la régulation génétique se fait au niveau de la transcription.Le cas des cellules eucaryotesLes cellules animales et végétales eucaryotes se distinguent par au moins deux caractères de la cellule bactérienne:– Ces cellules ont un noyau dans lequel l’ADN est enfermé; il est donc séparé du cytoplasme malgré les échanges nombreux qui peuvent s’effectuer à travers la double membrane qui entoure ce noyau. La transcription ne pourra donc pas être influencée simplement par le milieu extérieur.– Ces cellules sont différenciées , ce qui signifie qu’elles sont spécialisées dans une ou un petit nombre de fonctions. Chaque cellule ne synthétise donc pas l’ensemble des protéines que renferme l’organisme entier: ainsi l’hémoglobine est synthétisée dans les cellules de la moelle osseuse, mais la plupart des protéines du plasma sanguin se forment dans les cellules du foie. Cependant, toute vie cellulaire met en jeu un certain nombre de protéines, d’enzymes, qui doivent être synthétisées par toutes les cellules.La régulation génétique doit donc s’exercer à deux niveaux: détermination et activation.Premier niveau, la détermination . On avait pensé que l’ADN se répartissait de manière inégale au cours de la différenciation, chaque cellule recevant seulement les gènes dont elle a besoin. L’expérience de J. Gurdon a montré que ce n’était pas le cas. Cet embryologiste remplace les noyaux d’œufs de crapaud par des noyaux provenant de cellules hautement différenciées de cet animal adulte. Il constate qu’un certain nombre d’œufs se développent et donnent naissance à des crapauds complètement normaux. L’ADN des cellules différenciées contient donc la totalité des gènes de l’organisme. Mais, dans chaque type de cellule différenciée, certains gènes seront mis sous une forme particulière qui permettra leur expression après réception d’un signal. La nature de ces gènes varie avec la nature de la cellule différenciée.Second niveau, l’activation des gènes. Les gènes destinés à s’exprimer dans une cellule donnée ne le font pas en permanence. Ils devront recevoir à cet effet un signal qui peut être hormonal ou d’une autre nature. Par ailleurs, la régulation génétique dans les cellules eucaryotes ne se fait pas exclusivement au niveau de la transcription, mais à plusieurs niveaux successifs. On peut étudier ces régulations grâce aux anomalies susceptibles de se produire au cours de certaines circonstances pathologiques. Nous en donnerons deux exemples.L’hémoglobine synthétisée par le fœtus est différente de l’hémoglobine adulte; cependant, lors d’une maladie du sang, la thalassémie, on observe une synthèse d’hémoglobine fœtale chez l’adulte (il en est de même après de fortes hémorragies).Les cellules cancéreuses synthétisent des protéines et des enzymes qui normalement ne sont synthétisées que chez le fœtus: ce sont les protéines carcino-embryonnaires. Dans ces deux cas, il y a bien eu modification pathologique du programme de l’expression génétique.Structure de l’ADN des eucaryotesL’ADN est une molécule très longue; chez l’homme, l’ADN a plus de 1 mètre de long dans chaque cellule. On peut couper la molécule en fragments et comparer ceux-ci. On constate que ces fragments d’ADN peuvent se grouper en trois catégories:– des fragments hautement répétitifs, petits fragments d’ADN identiques à eux-mêmes présents dans la molécule en un très grand nombre d’exemplaires, de l’ordre du million; leur signification est inconnue;– des fragments moyennement répétitifs, fragments identiques à eux-mêmes et présents en quelques centaines ou quelques milliers d’exemplaires: deux catégories sont à distinguer. Le premier groupe comprend les gènes qui codent pour les ARN des ribosomes, les ARN de transfert (qui sont présents en plusieurs centaines d’exemplaires). Le second groupe comprend des fragments dispersés tout le long de l’ADN et qui, pense-t-on généralement, jouent un rôle régulateur vis-à-vis des gènes adjacents (rôle peut-être analogue à celui des gènes régulateurs des bactéries);– des fragments non répétés ou répétés un très petit nombre de fois; ils correspondent aux gènes qui codent pour les protéines.Les travaux (1981) de P. Chambon et de Flavell ont montré qu’un gène codant pour une protéine pouvait être en fait scindé en plusieurs fragments non adjacents, les exons , séparés par des fragments non codants, les introns . Ainsi le gène codant pour l’ovalbumine, protéine du blanc d’œuf, est formé de 13 fragments adjacents: 7 exons séparés par 6 introns. Les exons ne représentent que le tiers du gène total. Le gène codant pour une chaîne d’hémoglobine est formé de 5 parties adjacentes, 3 exons séparés par 2 introns. Il est possible que les introns interviennent soit au cours de la différenciation, soit lors du contrôle de l’expression des parties codantes voisines.La chromatineL’ADN n’est pas libre dans la cellule eucaryote. Dans les bactéries, il est combiné à une protéine, la protéine HU. Dans les cellules eucaryotes, l’ADN est combiné à de nombreuses protéines différentes; celles-ci sont importantes car elles interviennent dans la structuration spatiale de l’ADN et dans le contrôle de l’expression génétique. On appelle du nom déjà ancien de chromatine l’ADN et les protéines qui lui sont associées. Ces protéines appartiennent à 2 classes très différentes: histones et non histones.HistonesCes protéines sont de 5 types; ce sont des molécules basiques qui ont tendance à se combiner entre elles et à se combiner à l’ADN. En 1974-1975, plusieurs laboratoires ont établi que la chromatine était formée de subunités, les nucléosomes , composées de 4 types d’histones, présentes chacune à raison de 2 molécules et formant un disque compact. Ce disque est entouré d’un fragment d’ADN qui comprend 140 paires de nucléotides. L’ADN se continue d’une courte longueur, 20-80 paires de nucléotides, puis forme un nouveau nucléosome. On a une structure en perles, excepté que le fil, ici l’ADN, entoure les perles au lieu de les traverser. Un cinquième type d’histone est localisé en dehors de la structure nucléosomique. Les gènes font partie de la structure nucléosomique. Cependant, dans une cellule donnée, les gènes qui s’expriment ou qui sont destinés à s’exprimer à un moment donné de la vie de cette cellule sont dans un état particulier qui les rend accessibles aux enzymes de transcription.Les histones étant des constituants quasi universels des cellules, elles ne peuvent donc jouer un rôle régulateur direct. Cependant, ces protéines peuvent fixer, à l’aide d’enzymes présents dans la chromatine, des radicaux phosphates et acétyles. Des travaux récents montrent que la fixation de phosphate sur une histone, réaction catalysée par une enzyme, l’histone-kinase, est le facteur déclenchant de la division cellulaire (mitose) et que la fixation d’acétyle sur des histones serait un des signaux d’activation des gènes. Ainsi ces modifications des histones (appelées postsynthétiques car elles se produisent sur des histones déjà synthétisées) jouent un rôle régulateur important sur la prolifération cellulaire et sur l’expression génétique.Protéines non histonesLes protéines non histones forment la deuxième classe des protéines de la chromatine. Ce groupe est très hétérogène, il comprend plusieurs dizaines ou centaines de protéines différentes. On peut caractériser plusieurs groupes selon leur nature ou leur fonction:– Les enzymes qui permettent la synthèse de l’ADN, la transcription, les modifications postsynthétiques des histones.– Les récepteurs d’hormones: les hormones stéroïdes (hormones génitales mâles et femelles, hormones de la corticosurrénale) et l’hormone thyroïdienne ont été bien étudiées. Après leur sécrétion, les hormones stéroïdes se répandent dans toutes les cellules, mais seules les cellules sensibles, ou cellules cibles, à l’une de ces hormones possèdent dans leur cytoplasme ou leurs noyaux une protéine, le récepteur, qui fixera avec une forte affinité cette hormone; le complexe hormone-récepteur se liera à la chromatine. Le récepteur constitue alors une protéine non histone. La fixation du complexe se fera sur un site ou des sites bien définis de la chromatine et déclenchera la synthèse d’un ou d’un petit nombre d’ARN messagers. La nature du récepteur, le site de fixation sur la chromatine et la nature des ARN messagers synthétisés varient d’une hormone à l’autre et d’un type de cellule à l’autre. Ainsi, par ce mécanisme, les hormones stéroïdes exercent un effet régulateur sur l’expression génétique. L’hormone thyroïdienne agit également au niveau de la chromatine, mais son mécanisme d’action est différent. Cette hormone pénètre à l’état libre dans le noyau et elle se fixe sur un récepteur déjà présent dans la chromatine, parmi les protéines non histones. Cette fixation modifie les propriétés du récepteur et déclenche une série de phénomènes au niveau génétique, phénomènes qui diffèrent considérablement selon le type de cellule envisagé.– Des protéines contractiles ou liées à des mouvements intracellulaires, comme l’actine, la myosine interviennent dans la cytodiérèse; la tubuline joue probablement un rôle dans les mouvements de chromosomes qui se produisent au cours de la mitose.– Les protéines liées à l’ARN prémessager. Ce sont des constituants de la chromatine qui vont quitter celle-ci pour accompagner les ARN après leur synthèse.– Les protéines régulatrices, proprement dites, qui sont les moins connues quoique vraisemblablement les plus importantes. Cette régulation peut être assurée par la liaison de ces protéines, ou peut-être par des transformations postsynthétiques, comme des phosphorylations, car on a montré que la nature des phosphorylations des protéines non histones se modifie au cours de la croissance de la cellule et au cours de la différenciation. Parmi les protéines régulatrices, un groupe semble jouer un rôle important, le groupe HMG (high mobility group ). Ces protéines seraient responsables, par le site de leur liaison, de la détermination dans chaque cellule des gènes qui pourront être exprimés au cours de la vie de cette cellule: elles placeraient ces gènes dans un état leur permettant de recevoir le signal de fonctionnement.Transcription et maturationPour s’exprimer, un gène doit être transcrit en ARN. La transcription est catalysée par des enzymes, les ARN-polymérases. Celles-ci sont au nombre de trois:– l’ARN-polymérase I ou A, qui permet la synthèse des ARN des ribosomes dans des formations spéciales, les nucléoles;– l’ARN-polymérase II ou B, qui est responsable de la synthèse des ARN messagers;– l’ARN-polymérase III ou C, qui permet la synthèse des ARN de transfert et des petits ARN des ribosomes.Il est remarquable que les ARN qui sont synthétisés sont plus longs que les ARN définitifs; ils vont subir des modifications que l’on appelle maturation . La maturation consiste essentiellement en l’élimination de certaines parties de la molécule, mais également en quelques additions. Il est vraisemblable que la maturation, qui met en jeu des enzymes spécifiques, joue un rôle régulateur. On a en effet montré qu’il existait, dans le noyau, des précurseurs d’ARN messagers qui ne donneront jamais naissance à des ARN messagers fonctionnels. Tout se passe comme si, dans une cellule donnée, un trop grand nombre de gènes était transcrit et que, dans un second temps, au cours de la maturation, une seconde sélection s’opérait et que certains prémessagers étaient détruits. Ainsi la sélection des gènes qui seront exprimés dans une cellule donnée ne se fait pas seulement au niveau de la transcription, mais également lors d’étapes ultérieures par un processus séquentiel.Pour étudier la maturation des ARN, prenons l’exemple des ARN messagers. L’unité de transcription comprend le gène en entier avec les introns et les exons, ainsi que des segments antérieurs et postérieurs. Il en résulte un prémessager très long. Cet ARN va subir des coupures; les principales vont permettre d’éliminer les introns (parties non codantes du gène) du produit de transcription. Après l’élimination des introns, les exons se combinent entre eux de manière à avoir un ARN codant continu. Cependant, il reste sur cet ARN une partie antérieure et une partie postérieure non codantes, qui persisteront en partie dans l’ARN messager définitif. Une enzyme va intervenir ensuite, la poly A polymérase, qui va fixer sur la partie postérieure de l’ARN messager un fragment d’ARN formé de plusieurs dizaines de nucléotides d’un seul type (à adénine A) donnant des ARN messagers qui sont terminés par un segment poly A. Au début de la partie antérieure de l’ARN se fixe également un nucléotide particulier que l’on appelle le chapeau.Les parties non codantes, le poly A, le chapeau font partie de l’ARN messager définitif; comme les ARN prémessagers et les ARN messagers ne sont jamais libres mais combinés à des protéines qui proviennent de la chromatine, on a donc en fait des particules prémessagères qui comprennent les enzymes intervenant dans la maturation et qui peuvent recevoir des signaux régulateurs.Ainsi un ARN messager contient non seulement le code d’une protéine, mais également des informations permettant le contrôle de la synthèse de cette protéine.Régulation de la transcriptionNous avons vu que chez les bactéries la régulation de l’expression des gènes, c’est-à-dire de la synthèse protéique, se fait essentiellement au niveau de la transcription. C’est également en grande partie vrai chez les eucaryotes.On trouve dans l’ADN des eucaryotes, à environ 30 nucléotides en amont de la région codante de chaque gène, une séquence TATA , appelée boîte TATA, qui est le point de départ de l’ARN polymérase qui transcrit le gène. Il existe de plus, à des distances variables, mais parfois assez grandes, en amont ou en aval des gènes, des séquences d’ADN, appelées séquences stimulatrices . Ces séquences sont responsables de la transcription ou de la non-transcription du gène, et peut-être du niveau quantitatif de la transcription. Le fonctionnement de ces séquences dépend de la combinaison de protéines chromatiniennes présentes en très faible quantité et présentant un très haut niveau de spécificité. D’autres mécanismes peuvent également intervenir. Ainsi, la méthylation d’une des bases de l’ADN, la cytosine. Cette méthylation aura pour effet de supprimer ou de réduire la transcription du gène qui contiendra cette cytosine méthylée.L’amplification d’un gène peut jouer un rôle important. Certains facteurs, lorsqu’ils pénètrent dans la cellule, vont provoquer la réplication d’un gène qui, au lieu d’être présent en un seul exemplaire dans la cellule, sera présent en plusieurs centaines d’exemplaires, d’où une majoration du taux de transcription.Enfin, un autre mécanisme joue un rôle important dans la détermination de la concentration d’un ARN messager défini. Ce mécanisme, de nature encore inconnue, mais contrôlé génétiquement, porte sur la durée de demi-vie de l’ARN messager. Ainsi, la demi-vie d’un ARN peut être considérablement augmentée, ce qui aura pour conséquence d’augmenter sa quantité, donc celle de la protéine dont il contient le code.Traduction du message génétiqueLa synthèse protéique a lieu sur les ribosomes. L’ARN messager se fixe sur un ribosome ; il est parcouru par le ribosome de telle sorte que l’acide aminé qui correspond au trinucléotide codant présent sur le ribosome vienne se fixer, porté par le tARN auquel il est combiné. Chaque type de tARN est spécifique d’un type d’acide aminé d’une part et du trinucléotide qui contient le code de l’acide aminé d’autre part. Il s’ensuit que, si l’un de ces tARN n’est présent qu’en faible quantité, il limitera la vitesse de synthèse de la protéine, et des variations du taux du tARN, qui peuvent être commandées par des hormones, influeront sur cette vitesse de synthèse. Ainsi l’injection d’hormone sexuelle féminine à des poules augmente la synthèse par le foie du tARN porteur de l’acide aminé sérine. Or cette hormone provoque la synthèse par le foie de la phosvitine, protéine du jaune d’œuf très riche en sérine. Cette synthèse n’aurait pu s’effectuer rapidement si l’augmentation de tARN spécifique de la sérine ne s’était pas produite.Le ribosome est une particule complexe car elle contient nécessairement deux sites, un site qui reçoit le complexe acide aminé-tARN et un site qui porte le début de la protéine déjà formée. La synthèse protéique, ou traduction du message génétique au niveau de cet organite, comprend trois étapes successives.– L’initiation . Cette première étape inclut deux phénomènes: la liaison de l’ARN messager au ribosome; la fixation du premier acide aminé-tARN sur le ribosome. C’est donc le point de départ de la synthèse; elle est d’une extrême complexité et fait intervenir de nombreux facteurs dont sept au moins sont présents dans les ribosomes. L’existence de ces facteurs d’initiation rend possible une régulation complexe.– L’élongation de la chaîne polypeptidique, formée par adjonction d’acides aminés, est due à la progression du ribosome le long de l’ARN messager. À chaque mouvement, un acide aminé-tARN vient se fixer sur le ribosome, et, au mouvement suivant, l’acide aminé se fixe sur la chaîne protéique déjà synthétisée et qui est présente sur un autre site du ribosome. Lorsque le ribosome a entièrement parcouru l’ARN messager, la synthèse de la protéine est terminée. En réalité, plusieurs ribosomes parcourent en même temps un même ARN messager, ce qui fait que plusieurs molécules d’une protéine donnée sont synthétisées en même temps sur un même ARN messager. L’ensemble formé par plusieurs ribosomes combinés à un même ARN messager est appelé polysome .– Terminaison de la synthèse et libération de la protéine. Elle est sous le contrôle d’un facteur spécial, qui reconnaît sur l’ARN messager un signal indiquant la terminaison de la protéine, et qui libère la protéine terminée en la détachant du ribosome.Méthodes d’étude de l’expression des gènesUtilisation de cellules hybridesOn peut fusionner deux cellules de type différent par addition de polyéthylène glycol, on obtient un hétérocaryon avec 2 noyaux. Si on fusionne une cellule musculaire et une cellule non musculaire, on constate que le noyau de la cellule non musculaire synthétise des ARN messagers de protéines spécifiques de la cellule musculaire. On en conclut que des facteurs – très vraisemblablement protéiques – provenant de la partie musculaire de l’hétérocaryon ont stimulé des gènes auparavant silencieux du noyau non musculaire en agissant sur les séquences stimulatrices de ces gènes.TransfectionLes techniques de clonage permettent de préparer l’ADN correspondant à un gène unique. On peut faire pénétrer cet ADN dans des cellules pour y déterminer la synthèse par ces cellules de protéines correspondant à cet ADN. On peut injecter de l’ADN à des cellules germinales de souris, réimplanter ces cellules chez la mère et obtenir des animaux qui ont intégré l’ADN injecté dans leur patrimoine génétique. On a ainsi obtenu des animaux géants en injectant dans les cellules germinales de l’ADN codant pour de l’hormone de croissance. On a observé que si l’on injecte de l’ADN comportant non seulement la partie codante mais également les régions adjacentes qui comprennent les séquences régulatrices, l’ADN injecté ne s’exprime que dans les tissus dont il est spécifique. Les séquences adjacentes permettent donc de contrôler l’expression des gènes uniquement dans les cellules où ces gènes doivent provoquer la synthèse de protéines.Infection viraleOn peut fixer des gènes eucaryotes dans des virus. Lorsqu’on infecte des cellules avec ces virus, l’ADN viral peut s’incorporer dans l’ADN cellulaire et s’y exprimer. Cela est à la base de la thérapeutique génique que l’on est en train de mettre au point. On sait que la plupart des maladies héréditaires sont dues à des anomalies d’un gène qui s’exprime mal ou ne s’exprime pas. Si l’on infecte le malade avec un virus contenant le gène normal, on peut espérer corriger l’anomalie, ce qui est d’un intérêt considérable, à partir du moment où, par ailleurs, ces maladies ne relèvent que de thérapeutiques palliatives.2. Régulation métaboliqueMécanismes générauxMécanismes enzymatiques allostériquesLes enzymes allostériques sont des enzymes dont la cinétique peut être modifiée réversiblement par des composés dont la structure est éloignée de celle des substrats. Il existe des inhibiteurs et des activateurs allostériques. Lorsqu’une enzyme allostérique appartient à une chaîne métabolique, il arrive fréquemment que le produit terminal de la chaîne soit un inhibiteur allostérique de la première enzyme de celle-ci, ce qui évite une accumulation de ce produit final. Les témoins de charge énergétique sont des effecteurs allostériques, inhibant certaines enzymes, en activant d’autres, selon la logique des besoins cellulaires.Les enzymes allostériques sont toujours formées d’un nombre pair de sous-unités, l’ensemble possédant un axe de symétrie. Il existe un état actif appelé R et un état inactif T. Les deux formes sont en équilibre. Cet équilibre est déplacé par les activateurs et les inhibiteurs. La cinétique des enzymes allostériques (vitesse de réaction en fonction de la quantité de substrat) est sigmoïde, ce qui témoigne de la coopérativité des molécules de substrat vis-à-vis de l’enzyme; l’enzyme n’est pas active avec de faibles concentrations de substrats, sauf en présence d’activateur. La cinétique des enzymes non allostériques (à cinétique michaelienne) est hyperbolique, l’enzyme est active avec des concentrations faibles de substrat (fig. 2).Les enzymes clés des chaînes métaboliques sont des enzymes allostériques dont l’activité sera fonction des témoins de charge énergétique ou de l’accumulation des produits finaux du métabolisme.Mécanismes hormonauxDans le rôle de régulation métabolique qu’exercent les différentes hormones, deux mécanismes majeurs sont impliqués: modification de l’activité enzymatique ou induction de la synthèse d’enzymes.Phosphorylation d’enzymesBeaucoup d’enzymes existent sous deux formes, une forme phosphorylée et une forme non phosphorylée. La phosphorylation se fait par l’ATP:
La cinétique des enzymes allostériques (vitesse de réaction en fonction de la quantité de substrat) est sigmoïde, ce qui témoigne de la coopérativité des molécules de substrat vis-à-vis de l’enzyme; l’enzyme n’est pas active avec de faibles concentrations de substrats, sauf en présence d’activateur. La cinétique des enzymes non allostériques (à cinétique michaelienne) est hyperbolique, l’enzyme est active avec des concentrations faibles de substrat (fig. 2).Les enzymes clés des chaînes métaboliques sont des enzymes allostériques dont l’activité sera fonction des témoins de charge énergétique ou de l’accumulation des produits finaux du métabolisme.Mécanismes hormonauxDans le rôle de régulation métabolique qu’exercent les différentes hormones, deux mécanismes majeurs sont impliqués: modification de l’activité enzymatique ou induction de la synthèse d’enzymes.Phosphorylation d’enzymesBeaucoup d’enzymes existent sous deux formes, une forme phosphorylée et une forme non phosphorylée. La phosphorylation se fait par l’ATP: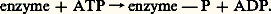 La déphosphorylation est réalisée par une phosphoprotéine phosphatase:
La déphosphorylation est réalisée par une phosphoprotéine phosphatase: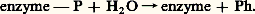 Les enzymes qui permettent la phosphorylation sont des protéines-kinases . Ces enzymes ont pour particularité de comprendre deux types de sous-unités, les sous-unités catalytiques C, qui effectuent la réaction de phosphorylation, les sous-unités régulatrices R, qui sont capables de fixer l’AMP cyclique. La fixation de l’AMP cyclique détache R de C qui devient alors actif, alors que RC ne l’est pas:
Les enzymes qui permettent la phosphorylation sont des protéines-kinases . Ces enzymes ont pour particularité de comprendre deux types de sous-unités, les sous-unités catalytiques C, qui effectuent la réaction de phosphorylation, les sous-unités régulatrices R, qui sont capables de fixer l’AMP cyclique. La fixation de l’AMP cyclique détache R de C qui devient alors actif, alors que RC ne l’est pas: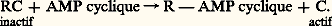 L’AMP cyclique (AMPC) provient de l’action d’une enzyme membranaire, l’adénylcyclase , sur l’ATP:
L’AMP cyclique (AMPC) provient de l’action d’une enzyme membranaire, l’adénylcyclase , sur l’ATP: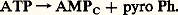 L’adénylcyclase est inactive, mais si une hormone se fixe sur un récepteur membranaire spécifique, ce dernier déclenche, par l’intermédiaire d’un transducteur, l’activation de l’adénylcyclase, donc la synthèse de l’AMPC, d’où activation d’une protéine-kinase (fig. 3).Ainsi, dans les cellules cibles, la phosphorylation d’enzymes est déclenchée par la fixation d’hormones sur la membrane plasmique.Les hormones agissant par ce mécanisme sont en général des hormones peptidiques (glucagon, hormones hypophysaires et hypothalamiques, etc.) et des hormones dérivées d’acides aminés (adrénaline...).Certaines enzymes sont activées sous forme phosphorylée; les hormones de cette catégorie activent donc ces enzymes. D’autres enzymes sont actives sous forme non phosphorylée; elles sont inactivées par ces hormones.L’insuline, hormone peptidique, favorise la déphosphorylation d’enzymes; elle a donc une action opposée à celle des hormones précédentes. Son mécanisme d’action n’est pas connu, mais tout se passe comme si elle activait les phosphoprotéines-phosphatases.Cette régulation est indépendante de l’effet allostérique, mais certaines enzymes allostériques peuvent être phosphorylables.Induction de la synthèse d’enzymesCertaines hormones ne modifient pas l’activité d’enzymes existantes, mais induisent la synthèse d’enzymes. C’est essentiellement le cas des hormones stéroïdes qui sont transportées dans le sang associées à des protéines. Au niveau des tissus, elles se détachent des protéines plasmatiques et pénètrent librement à l’intérieur des cellules. Dans les cellules cibles , elles agissent sur des récepteurs (ce sont des protéines) qui changent de conformation, permettant à ce complexe hormone-récepteur de se fixer dans la chromatine, en différents endroits appelés sites accepteurs (fig. 4). Cette fixation met en jeu l’ADN et par suite modifie l’expression génétique, comme il a été dit précédemment (régulation génétique par l’intermédiaire de protéines non histones), en stimulant un ou quelques gènes. Ainsi se produira une synthèse d’ARN messagers spécifiques qui seront traduits en protéines, en l’occurrence enzymes, dans le cytoplasme sur les ribosomes.Il existe d’autres hormones agissant par induction de synthèse d’enzymes; c’est vraisemblablement le cas pour l’insuline et le glucagon (indépendamment de leur action sur l’activité enzymatique), mais le mécanisme d’action est totalement inconnu.Régulation par l’ion calciumL’ion calcium joue un rôle régulateur essentiel, qui est maintenant bien connu. Il n’est présent qu’en très faible concentration dans la cellule, mais il existe un système membranaire qui contrôle sa pénétration cellulaire (ATPase Ca dépendante). Le Ca++ n’agit en général pas libre, mais combiné à des protéines spécifiques, la troponine dans le muscle strié, mais surtout la calmoduline. Cette dernière, très répandue dans la plupart des cellules, est capable de fixer le Ca++. Cette fixation s’accompagne d’un changement de conformation de la protéine. La calmoduline peut alors se combiner à d’autres protéines et enzymes en modifiant leur activité. Ainsi, le complexe Ca++-calmoduline (ou troponine) intervient dans la contraction musculaire, dans le contrôle du métabolisme du glycogène, dans la production des neuro-transmetteurs, la maturation de l’œuf, la mobilité cellulaire, le mouvement des chromosomes, etc.On compare le rôle du complexe Ca à celui de l’AMP cyclique, dont d’ailleurs il contrôle la synthèse dans certaines cellules.Rôle régulateur des membranesLes membranes jouent un rôle régulateur important. Nous avons vu leur rôle comme intermédiaire de l’action d’hormones agissant sur la synthèse d’AMPC, comme siège de régulation du métabolisme du Ca++, comme siège des transferts d’ATP et d’AMP dans les mitochondries. En fait, les membranes contrôlent les transferts de molécules entre le milieu extracellulaire et la cellule, ainsi qu’entre différents compartiments cellulaires.On doit envisager, pour la membrane plasmique (membrane qui entoure la cellule), essentiellement un rôle dans la pénétration des petites molécules, un rôle dans la pénétration des macromolécules et un rôle dans le contrôle de la croissance cellulaire.Pénétration des petites moléculesLa pénétration des petites molécules se fait en général par des mécanismes spécifiques actifs. Il existe dans l’épaisseur de la membrane plasmique des protéines qui sont capables de reconnaître les différentes molécules, ou classes de molécules, et de les faire pénétrer à l’intérieur de la cellule. Cette pénétration ne se fait pas par simple diffusion, car elle va permettre l’accumulation dans la cellule des métabolites importants; elle nécessitera donc la fourniture d’énergie sous forme d’ATP (qui se transforme en ADP). Un mécanisme spécifique de la membrane interne des mitochondries assure la pénétration et la sortie de petites molécules dans la matrice des mitochondries.Pénétration des macromoléculesLa pénétration de macromolécules, telles que l’insuline, les lipoprotéines – en particulier celles qui transportent le cholestérol –, la transferrine – qui transporte le fer –, les facteurs de croissance, se fait selon le mécanisme suivant: les macromolécules se fixent sur des récepteurs membranaires spécifiques, qui se rassemblent dans une même région de la cellule. La partie de la membrane comprenant les récepteurs s’invagine par un repli et finalement forme une vésicule qui pénètre dans la cellule. L’ensemble est désagrégé par les lysosomes, la macromolécule est libérée à l’intérieur de la cellule, les récepteurs retournent sur la membrane plasmique où ils seront réutilisés. Cela est cependant soumis à régulation. Ainsi, dans le cas de cholestérol dont l’origine est à la fois alimentaire et endogène, la présence d’une grande quantité de ce composé dans la cellule empêchera le retour des récepteurs sur la membrane plasmique et donc la pénétration de nouvelles molécules de lipoprotéines contenant du cholestérol.Contrôle de la croissanceIl existe à la surface des cellules des récepteurs de facteurs de croissance. La fixation d’un de ces facteurs sur les récepteurs va déclencher la multiplication cellulaire. Il existe également, à la surface de cellules animales, des récepteurs de composés végétaux, les lectines, qui déclenchent également la multiplication cellulaire.Régulation des grands métabolismesMétabolisme énergétiqueLa respiration cellulaire est le mécanisme majeur de dégradation finale des métabolites, qui aboutit à la formation de l’ATP dans les mitochondries. L’ATP est un inhibiteur de la respiration, l’ADP un activateur (fig. 1). Le rapport ATP/ADP + Ph contrôle l’intensité de la respiration. Si la respiration est ralentie, le transporteur d’hydrogène NADH2 s’accumule, puisqu’il ne peut plus céder l’hydrogène en se transformant en NAD: ainsi, NADH2 est un signal de charge énergétique élevée et NAD un signal de charge énergétique basse.Le cycle de Krebs est la phase terminale de la dégradation de la plupart des métabolites: il a lieu dans les mitochondries, en étroite relation avec la respiration cellulaire. À partir de l’acide pyruvique, le cycle de Krebs termine la glycolyse anaérobie, ainsi que la dégradation de certains acides aminés; à partir de l’acétyl-CoA, il termine la dégradation des acides gras et de certains acides aminés. La première étape est la formation d’acide citrique catalysé par le citrate synthétase; l’acide citrique est transformé en acide isocitrique qui est oxydé par l’isocitricodéshydrogénase (fig. 5). Ces deux enzymes sont soumises à régulation allostérique, elles sont inhibées par ATP et NADH2. Les déshydrogénases de l’acide pyruvique et de l’acide isocitrique sont activées par l’ADP. Un ralentissement du cycle de Krebs provoque une accumulation de l’acide citrique et de l’acétyl-CoA. Ceux-ci sont des témoins de charge énergétique élevée.Métabolisme des glucidesLe métabolisme glucidique est complexe. Le glucose alimentaire arrive dans le foie où il est phosphorylé en glucose-6-phosphate. Ce composé peut suivre plusieurs voies en fonction des signaux régulateurs allostériques et hormonaux:– la glycolyse anaérobie, voie de dégradation très généralement répandue, peu productrice d’énergie, mais qui va aboutir à l’acide pyruvique, qui, après transformation en acétyl-CoA, subira les réactions du cycle de Krebs qui produisent une grande quantité d’ATP;– le cycle des pentoses phosphates, autre voie dégradative, est généralement associé à la synthèse des acides gras et des hormones stéroïdes; sa régulation étant peu connue, nous n’envisagerons pas cette voie;– la mise en réserve sous forme de glycogène. La synthèse et la dégradation du glycogène sont soumises à de puissantes régulations, essentiellement hormonales. Dans le foie, la dégradation du glycogène aboutit au glucose, qui passe dans le sang; dans le muscle, cette dégradation se poursuit jusqu’au cycle de Krebs. En effet, dans le foie, le glycogène est une réserve de sucre qui permet de contrôler le taux du glucose sanguin, mais, dans le muscle, le glycogène est une réserve énergétique;– l’hydrolyse, dans le foie, du glucose-6-phosphate en glucose et phosphate, qui passent dans la circulation générale;– une voie capitale remonte la voie de la glycolyse pour aboutir au glucose et au glycogène: c’est la gluconéogenèse et la glycogénonéogenèse. Le point de départ est l’acide pyruvique ou l’un des constituants du cycle de Krebs. Ces voies métaboliques permettent de former du glucose et éventuellement du glycogène alors que le régime est dépourvu de glucides.Le glucose est essentiel pour certains organes, tels le cerveau, le cristallin. La glycolyse et la glycogénonéogenèse sont catalysées par les mêmes enzymes, qui agissent dans un sens ou dans l’autre selon la concentration relative des substrats. Il existe cependant entre le glucose-6-phosphate et l’acide pyruvique deux étapes qui, pour des raisons énergétiques, ne peuvent être réversibles; ce sont ces étapes qui sont essentiellement soumises à régulation.Régulation allostériqueDeux enzymes sont soumises à régulation allostérique dans la glycolyse anaérobie, la phosphofructokinase (fructose-6-Pfructose-1,6-di-P) et la pyruvate-kinase (acide phénolpyruviqueacide pyruvique). Ces deux enzymes sont activées par l’ADP et l’AMP, inhibées par les témoins de charge énergétique élevée (fig. 6). Les réactions inverses, qui prennent place lors de la synthèse des glucides à partir de l’acide pyruvique et de constituants du cycle de Krebs, sont catalysées par la fructose-diphosphatase (fructose-1,6-di-Pfructose-6-P), et par une carboxylase et une carboxykinase (acide pyruviqueacide oxaloacétiqueacide phénolpyruvique). La diphosphatase est activée par l’ATP, le NADH2 et l’acide citrique, inhibée par l’ADP et l’AMP. Il existe donc une régulation réciproque des deux enzymes agissant sur ces dérivés phosphorylés du fructose. La carboxylase de l’acide pyruvique est activée par l’acétyl-CoA, témoin de charge énergétique élevée. Ainsi, une charge énergétique basse va activer la glycolyse anaérobie, une charge énergétique élevée va l’inhiber et activer la synthèse du glucose et surtout du glycogène. Une charge énergétique basse active la dégradation du glycogène. Par ailleurs, si le métabolisme du glucose-6-P est bloqué, ce composé, en s’accumulant, va empêcher sa propre formation en inhibant l’hexokinase.Régulation hormonaleInterviennent essentiellement les hormones agissant sur les phosphorylations et plus particulièrement dans le foie, le glucagon et l’insuline, ainsi que les hormones glucocorticoïdes agissant sur la synthèse d’enzymes. La synthèse du glycogène à partir du glucose-1-phosphate met en jeu la glycogène synthétase, enzyme qui existe sous deux formes, une forme active non phosphorylée et une forme inactive phosphorylée. La déphosphorylation est activée par l’insuline. Les glucocorticoïdes augmentent l’activité ou la synthèse de la phosphatase. Ces deux hormones favorisent donc la synthèse de glycogène. En revanche, le glucagon dans le foie, l’adrénaline dans le muscle et le foie, par l’intermédiaire d’AMPC et d’une protéine-kinase, favorisent la phosphorylation et donc l’inactivation de l’enzyme. La dégradation du glycogène est catalysée par la phosphorylase, enzyme qui existe sous forme active phosphorylée et sous forme inactive déphosphorylée. Les mêmes hormones agiront donc, mais en sens inverse; l’adrénaline et le glucagon activent la dégradation du glycogène, l’insuline l’empêche. Mais dans le cas de la phosphorylase, l’action de l’AMPC n’est pas directe; elle se fait au contraire par une réaction intermédiaire, mettant en jeu une enzyme intermédiaire, la phosphorylase-kinase qui est l’enzyme phosphorylant la phosphorylase. L’AMP cyclique active la protéine-kinase qui active la phosphorylase-kinase en la phosphorylant, et c’est cette dernière qui catalyse la phosphorylation de la phosphorylase. Il s’agit donc d’une réaction en cascade qui permet d’amplifier le phénomène, chaque enzyme ayant une action catalytique (fig. 7 et 8).La régulation hormonale de la glycolyse anaérobie se fait aux mêmes niveaux que la régulation allostérique: la phosphorylation du fructose-6-P en fructose-1,6-di-P est activée par l’insuline, inhibée par l’adrénaline et le glucagon. En fait, cette régulation se fait par l’intermédiaire d’un composé régulateur, le fructose-2,6-di-P qui active la réaction. Les hormones agissent en contrôlant la concentration de ce dernier composé. L’insuline active également la pyruvate-kinase, qui permet le passage de l’acide phénolpyruvique à l’acide pyruvique, et la pyruvate déshydrogénase, qui permet la pénétration de l’acide pyruvique dans le cycle de Krebs.Les enzymes agissant dans le sens de la synthèse des glucides à partir de l’acide pyruvique et des constituants du cycle de Krebs sont activées par le glucagon et leur quantité augmentée par les glucocorticoïdes. Ces régulations se font, d’une part, au niveau du passage de l’acide pyruvique à l’acide phosphoénolpyruvique, d’autre part, au niveau du passage du fructose-1,6-di-P au fructose-6-P.On peut résumer l’action des trois hormones ainsi: l’insuline active la glycolyse anaérobie d’une part, la synthèse du glycogène d’autre part. Les glucocorticoïdes activent la glycogénonéogenèse, c’est-à-dire la synthèse du glycogène à partir de l’acide pyruvique et des constituants du cycle de Krebs. Le glucagon active la formation du glucose, d’une part, par dégradation du glycogène, d’autre part, par synthèse de glucose à partir de l’acide pyruvique et des constituants du cycle de Krebs, c’est-à-dire la glyconéogenèse. Les organes cibles sont le foie pour l’insuline, les glucocorticoïdes et le glucagon, le muscle pour l’insuline; dans le muscle, il n’y a pas de glyconéogenèse, et l’adrénaline active la dégradation du glycogène.Ca++ et calmodulineLe calcium est un activateur de certaines protéines-kinases. Le complexe Ca-calmoduline, en activant ces protéines-kinases, active la phosphorylase, donc la dégradation du glycogène (fig. 8). Cette régulation est particulièrement importante dans le muscle, car l’ion Ca++ déclenche la contraction musculaire. Cet ion permet donc de fournir en même temps l’énergie nécessaire à la contraction. Par ailleurs, la calmoduline est un constituant de la phosphorylase-kinase et la présence de Ca++ est indispensable au fonctionnement de cette enzyme qui active la phosphorylase.Par ailleurs, l’AMP est un activateur allostérique de la phosphorylase dite inactive; le glucose contribue à l’activation de la glycogène-synthétase du foie.Métabolisme des lipidesLes lipides représentent une forme majeure de réserve d’énergie, tant du fait de leur quantité que du fait que l’oxydation d’un gramme de lipides fournit près de deux fois plus de calories que celle d’un gramme de glucides. Les lipides à vocation bioénergétique sont les triglycérides, formés pour l’essentiel d’un trialcool, le glycérol et de trois acides gras qui estérifient le glycérol. Il existe d’autres types de lipides, mais ces derniers n’ont en général pas de rôle énergétique; ils jouent un rôle de structure des membranes.Les triglycérides sont accumulés dans des cellules appelées adipocytes. La première étape de production d’énergie est la lipolyse, qui est l’hydrolyse des triglycérides en glycérol et acides gras. Les acides gras sont dégradés sur place ou dans d’autres organes, comme le foie, par une chaîne de déshydrogénation qui aboutit à l’acétyl-CoA. Seule la lipolyse est soumise à régulation. L’acétyl-CoA peut suivre différentes voies métaboliques:a ) Il peut subir les réactions du cycle de Krebs et être ainsi entièrement dégradé par un mécanisme producteur d’énergie.b ) Il peut, dans le foie, se transformer en acide acétylacétique, c’est la cétogénèse. Ce composé passe dans le sang où il est capté par différents organes qui, après l’avoir transformé en acétyl-CoA (acétylcoenzyme A), l’utilisent pour leurs besoins énergétiques. Les lipides sont donc les précurseurs de deux groupes d’aliments pour les cellules, les acides gras et l’acide acétylacétique;c ) L’acétyl-CoA est le précurseur de la synthèse des acides gras: la première réaction est une carboxylation qui le transforme en malonyl-CoA
L’adénylcyclase est inactive, mais si une hormone se fixe sur un récepteur membranaire spécifique, ce dernier déclenche, par l’intermédiaire d’un transducteur, l’activation de l’adénylcyclase, donc la synthèse de l’AMPC, d’où activation d’une protéine-kinase (fig. 3).Ainsi, dans les cellules cibles, la phosphorylation d’enzymes est déclenchée par la fixation d’hormones sur la membrane plasmique.Les hormones agissant par ce mécanisme sont en général des hormones peptidiques (glucagon, hormones hypophysaires et hypothalamiques, etc.) et des hormones dérivées d’acides aminés (adrénaline...).Certaines enzymes sont activées sous forme phosphorylée; les hormones de cette catégorie activent donc ces enzymes. D’autres enzymes sont actives sous forme non phosphorylée; elles sont inactivées par ces hormones.L’insuline, hormone peptidique, favorise la déphosphorylation d’enzymes; elle a donc une action opposée à celle des hormones précédentes. Son mécanisme d’action n’est pas connu, mais tout se passe comme si elle activait les phosphoprotéines-phosphatases.Cette régulation est indépendante de l’effet allostérique, mais certaines enzymes allostériques peuvent être phosphorylables.Induction de la synthèse d’enzymesCertaines hormones ne modifient pas l’activité d’enzymes existantes, mais induisent la synthèse d’enzymes. C’est essentiellement le cas des hormones stéroïdes qui sont transportées dans le sang associées à des protéines. Au niveau des tissus, elles se détachent des protéines plasmatiques et pénètrent librement à l’intérieur des cellules. Dans les cellules cibles , elles agissent sur des récepteurs (ce sont des protéines) qui changent de conformation, permettant à ce complexe hormone-récepteur de se fixer dans la chromatine, en différents endroits appelés sites accepteurs (fig. 4). Cette fixation met en jeu l’ADN et par suite modifie l’expression génétique, comme il a été dit précédemment (régulation génétique par l’intermédiaire de protéines non histones), en stimulant un ou quelques gènes. Ainsi se produira une synthèse d’ARN messagers spécifiques qui seront traduits en protéines, en l’occurrence enzymes, dans le cytoplasme sur les ribosomes.Il existe d’autres hormones agissant par induction de synthèse d’enzymes; c’est vraisemblablement le cas pour l’insuline et le glucagon (indépendamment de leur action sur l’activité enzymatique), mais le mécanisme d’action est totalement inconnu.Régulation par l’ion calciumL’ion calcium joue un rôle régulateur essentiel, qui est maintenant bien connu. Il n’est présent qu’en très faible concentration dans la cellule, mais il existe un système membranaire qui contrôle sa pénétration cellulaire (ATPase Ca dépendante). Le Ca++ n’agit en général pas libre, mais combiné à des protéines spécifiques, la troponine dans le muscle strié, mais surtout la calmoduline. Cette dernière, très répandue dans la plupart des cellules, est capable de fixer le Ca++. Cette fixation s’accompagne d’un changement de conformation de la protéine. La calmoduline peut alors se combiner à d’autres protéines et enzymes en modifiant leur activité. Ainsi, le complexe Ca++-calmoduline (ou troponine) intervient dans la contraction musculaire, dans le contrôle du métabolisme du glycogène, dans la production des neuro-transmetteurs, la maturation de l’œuf, la mobilité cellulaire, le mouvement des chromosomes, etc.On compare le rôle du complexe Ca à celui de l’AMP cyclique, dont d’ailleurs il contrôle la synthèse dans certaines cellules.Rôle régulateur des membranesLes membranes jouent un rôle régulateur important. Nous avons vu leur rôle comme intermédiaire de l’action d’hormones agissant sur la synthèse d’AMPC, comme siège de régulation du métabolisme du Ca++, comme siège des transferts d’ATP et d’AMP dans les mitochondries. En fait, les membranes contrôlent les transferts de molécules entre le milieu extracellulaire et la cellule, ainsi qu’entre différents compartiments cellulaires.On doit envisager, pour la membrane plasmique (membrane qui entoure la cellule), essentiellement un rôle dans la pénétration des petites molécules, un rôle dans la pénétration des macromolécules et un rôle dans le contrôle de la croissance cellulaire.Pénétration des petites moléculesLa pénétration des petites molécules se fait en général par des mécanismes spécifiques actifs. Il existe dans l’épaisseur de la membrane plasmique des protéines qui sont capables de reconnaître les différentes molécules, ou classes de molécules, et de les faire pénétrer à l’intérieur de la cellule. Cette pénétration ne se fait pas par simple diffusion, car elle va permettre l’accumulation dans la cellule des métabolites importants; elle nécessitera donc la fourniture d’énergie sous forme d’ATP (qui se transforme en ADP). Un mécanisme spécifique de la membrane interne des mitochondries assure la pénétration et la sortie de petites molécules dans la matrice des mitochondries.Pénétration des macromoléculesLa pénétration de macromolécules, telles que l’insuline, les lipoprotéines – en particulier celles qui transportent le cholestérol –, la transferrine – qui transporte le fer –, les facteurs de croissance, se fait selon le mécanisme suivant: les macromolécules se fixent sur des récepteurs membranaires spécifiques, qui se rassemblent dans une même région de la cellule. La partie de la membrane comprenant les récepteurs s’invagine par un repli et finalement forme une vésicule qui pénètre dans la cellule. L’ensemble est désagrégé par les lysosomes, la macromolécule est libérée à l’intérieur de la cellule, les récepteurs retournent sur la membrane plasmique où ils seront réutilisés. Cela est cependant soumis à régulation. Ainsi, dans le cas de cholestérol dont l’origine est à la fois alimentaire et endogène, la présence d’une grande quantité de ce composé dans la cellule empêchera le retour des récepteurs sur la membrane plasmique et donc la pénétration de nouvelles molécules de lipoprotéines contenant du cholestérol.Contrôle de la croissanceIl existe à la surface des cellules des récepteurs de facteurs de croissance. La fixation d’un de ces facteurs sur les récepteurs va déclencher la multiplication cellulaire. Il existe également, à la surface de cellules animales, des récepteurs de composés végétaux, les lectines, qui déclenchent également la multiplication cellulaire.Régulation des grands métabolismesMétabolisme énergétiqueLa respiration cellulaire est le mécanisme majeur de dégradation finale des métabolites, qui aboutit à la formation de l’ATP dans les mitochondries. L’ATP est un inhibiteur de la respiration, l’ADP un activateur (fig. 1). Le rapport ATP/ADP + Ph contrôle l’intensité de la respiration. Si la respiration est ralentie, le transporteur d’hydrogène NADH2 s’accumule, puisqu’il ne peut plus céder l’hydrogène en se transformant en NAD: ainsi, NADH2 est un signal de charge énergétique élevée et NAD un signal de charge énergétique basse.Le cycle de Krebs est la phase terminale de la dégradation de la plupart des métabolites: il a lieu dans les mitochondries, en étroite relation avec la respiration cellulaire. À partir de l’acide pyruvique, le cycle de Krebs termine la glycolyse anaérobie, ainsi que la dégradation de certains acides aminés; à partir de l’acétyl-CoA, il termine la dégradation des acides gras et de certains acides aminés. La première étape est la formation d’acide citrique catalysé par le citrate synthétase; l’acide citrique est transformé en acide isocitrique qui est oxydé par l’isocitricodéshydrogénase (fig. 5). Ces deux enzymes sont soumises à régulation allostérique, elles sont inhibées par ATP et NADH2. Les déshydrogénases de l’acide pyruvique et de l’acide isocitrique sont activées par l’ADP. Un ralentissement du cycle de Krebs provoque une accumulation de l’acide citrique et de l’acétyl-CoA. Ceux-ci sont des témoins de charge énergétique élevée.Métabolisme des glucidesLe métabolisme glucidique est complexe. Le glucose alimentaire arrive dans le foie où il est phosphorylé en glucose-6-phosphate. Ce composé peut suivre plusieurs voies en fonction des signaux régulateurs allostériques et hormonaux:– la glycolyse anaérobie, voie de dégradation très généralement répandue, peu productrice d’énergie, mais qui va aboutir à l’acide pyruvique, qui, après transformation en acétyl-CoA, subira les réactions du cycle de Krebs qui produisent une grande quantité d’ATP;– le cycle des pentoses phosphates, autre voie dégradative, est généralement associé à la synthèse des acides gras et des hormones stéroïdes; sa régulation étant peu connue, nous n’envisagerons pas cette voie;– la mise en réserve sous forme de glycogène. La synthèse et la dégradation du glycogène sont soumises à de puissantes régulations, essentiellement hormonales. Dans le foie, la dégradation du glycogène aboutit au glucose, qui passe dans le sang; dans le muscle, cette dégradation se poursuit jusqu’au cycle de Krebs. En effet, dans le foie, le glycogène est une réserve de sucre qui permet de contrôler le taux du glucose sanguin, mais, dans le muscle, le glycogène est une réserve énergétique;– l’hydrolyse, dans le foie, du glucose-6-phosphate en glucose et phosphate, qui passent dans la circulation générale;– une voie capitale remonte la voie de la glycolyse pour aboutir au glucose et au glycogène: c’est la gluconéogenèse et la glycogénonéogenèse. Le point de départ est l’acide pyruvique ou l’un des constituants du cycle de Krebs. Ces voies métaboliques permettent de former du glucose et éventuellement du glycogène alors que le régime est dépourvu de glucides.Le glucose est essentiel pour certains organes, tels le cerveau, le cristallin. La glycolyse et la glycogénonéogenèse sont catalysées par les mêmes enzymes, qui agissent dans un sens ou dans l’autre selon la concentration relative des substrats. Il existe cependant entre le glucose-6-phosphate et l’acide pyruvique deux étapes qui, pour des raisons énergétiques, ne peuvent être réversibles; ce sont ces étapes qui sont essentiellement soumises à régulation.Régulation allostériqueDeux enzymes sont soumises à régulation allostérique dans la glycolyse anaérobie, la phosphofructokinase (fructose-6-Pfructose-1,6-di-P) et la pyruvate-kinase (acide phénolpyruviqueacide pyruvique). Ces deux enzymes sont activées par l’ADP et l’AMP, inhibées par les témoins de charge énergétique élevée (fig. 6). Les réactions inverses, qui prennent place lors de la synthèse des glucides à partir de l’acide pyruvique et de constituants du cycle de Krebs, sont catalysées par la fructose-diphosphatase (fructose-1,6-di-Pfructose-6-P), et par une carboxylase et une carboxykinase (acide pyruviqueacide oxaloacétiqueacide phénolpyruvique). La diphosphatase est activée par l’ATP, le NADH2 et l’acide citrique, inhibée par l’ADP et l’AMP. Il existe donc une régulation réciproque des deux enzymes agissant sur ces dérivés phosphorylés du fructose. La carboxylase de l’acide pyruvique est activée par l’acétyl-CoA, témoin de charge énergétique élevée. Ainsi, une charge énergétique basse va activer la glycolyse anaérobie, une charge énergétique élevée va l’inhiber et activer la synthèse du glucose et surtout du glycogène. Une charge énergétique basse active la dégradation du glycogène. Par ailleurs, si le métabolisme du glucose-6-P est bloqué, ce composé, en s’accumulant, va empêcher sa propre formation en inhibant l’hexokinase.Régulation hormonaleInterviennent essentiellement les hormones agissant sur les phosphorylations et plus particulièrement dans le foie, le glucagon et l’insuline, ainsi que les hormones glucocorticoïdes agissant sur la synthèse d’enzymes. La synthèse du glycogène à partir du glucose-1-phosphate met en jeu la glycogène synthétase, enzyme qui existe sous deux formes, une forme active non phosphorylée et une forme inactive phosphorylée. La déphosphorylation est activée par l’insuline. Les glucocorticoïdes augmentent l’activité ou la synthèse de la phosphatase. Ces deux hormones favorisent donc la synthèse de glycogène. En revanche, le glucagon dans le foie, l’adrénaline dans le muscle et le foie, par l’intermédiaire d’AMPC et d’une protéine-kinase, favorisent la phosphorylation et donc l’inactivation de l’enzyme. La dégradation du glycogène est catalysée par la phosphorylase, enzyme qui existe sous forme active phosphorylée et sous forme inactive déphosphorylée. Les mêmes hormones agiront donc, mais en sens inverse; l’adrénaline et le glucagon activent la dégradation du glycogène, l’insuline l’empêche. Mais dans le cas de la phosphorylase, l’action de l’AMPC n’est pas directe; elle se fait au contraire par une réaction intermédiaire, mettant en jeu une enzyme intermédiaire, la phosphorylase-kinase qui est l’enzyme phosphorylant la phosphorylase. L’AMP cyclique active la protéine-kinase qui active la phosphorylase-kinase en la phosphorylant, et c’est cette dernière qui catalyse la phosphorylation de la phosphorylase. Il s’agit donc d’une réaction en cascade qui permet d’amplifier le phénomène, chaque enzyme ayant une action catalytique (fig. 7 et 8).La régulation hormonale de la glycolyse anaérobie se fait aux mêmes niveaux que la régulation allostérique: la phosphorylation du fructose-6-P en fructose-1,6-di-P est activée par l’insuline, inhibée par l’adrénaline et le glucagon. En fait, cette régulation se fait par l’intermédiaire d’un composé régulateur, le fructose-2,6-di-P qui active la réaction. Les hormones agissent en contrôlant la concentration de ce dernier composé. L’insuline active également la pyruvate-kinase, qui permet le passage de l’acide phénolpyruvique à l’acide pyruvique, et la pyruvate déshydrogénase, qui permet la pénétration de l’acide pyruvique dans le cycle de Krebs.Les enzymes agissant dans le sens de la synthèse des glucides à partir de l’acide pyruvique et des constituants du cycle de Krebs sont activées par le glucagon et leur quantité augmentée par les glucocorticoïdes. Ces régulations se font, d’une part, au niveau du passage de l’acide pyruvique à l’acide phosphoénolpyruvique, d’autre part, au niveau du passage du fructose-1,6-di-P au fructose-6-P.On peut résumer l’action des trois hormones ainsi: l’insuline active la glycolyse anaérobie d’une part, la synthèse du glycogène d’autre part. Les glucocorticoïdes activent la glycogénonéogenèse, c’est-à-dire la synthèse du glycogène à partir de l’acide pyruvique et des constituants du cycle de Krebs. Le glucagon active la formation du glucose, d’une part, par dégradation du glycogène, d’autre part, par synthèse de glucose à partir de l’acide pyruvique et des constituants du cycle de Krebs, c’est-à-dire la glyconéogenèse. Les organes cibles sont le foie pour l’insuline, les glucocorticoïdes et le glucagon, le muscle pour l’insuline; dans le muscle, il n’y a pas de glyconéogenèse, et l’adrénaline active la dégradation du glycogène.Ca++ et calmodulineLe calcium est un activateur de certaines protéines-kinases. Le complexe Ca-calmoduline, en activant ces protéines-kinases, active la phosphorylase, donc la dégradation du glycogène (fig. 8). Cette régulation est particulièrement importante dans le muscle, car l’ion Ca++ déclenche la contraction musculaire. Cet ion permet donc de fournir en même temps l’énergie nécessaire à la contraction. Par ailleurs, la calmoduline est un constituant de la phosphorylase-kinase et la présence de Ca++ est indispensable au fonctionnement de cette enzyme qui active la phosphorylase.Par ailleurs, l’AMP est un activateur allostérique de la phosphorylase dite inactive; le glucose contribue à l’activation de la glycogène-synthétase du foie.Métabolisme des lipidesLes lipides représentent une forme majeure de réserve d’énergie, tant du fait de leur quantité que du fait que l’oxydation d’un gramme de lipides fournit près de deux fois plus de calories que celle d’un gramme de glucides. Les lipides à vocation bioénergétique sont les triglycérides, formés pour l’essentiel d’un trialcool, le glycérol et de trois acides gras qui estérifient le glycérol. Il existe d’autres types de lipides, mais ces derniers n’ont en général pas de rôle énergétique; ils jouent un rôle de structure des membranes.Les triglycérides sont accumulés dans des cellules appelées adipocytes. La première étape de production d’énergie est la lipolyse, qui est l’hydrolyse des triglycérides en glycérol et acides gras. Les acides gras sont dégradés sur place ou dans d’autres organes, comme le foie, par une chaîne de déshydrogénation qui aboutit à l’acétyl-CoA. Seule la lipolyse est soumise à régulation. L’acétyl-CoA peut suivre différentes voies métaboliques:a ) Il peut subir les réactions du cycle de Krebs et être ainsi entièrement dégradé par un mécanisme producteur d’énergie.b ) Il peut, dans le foie, se transformer en acide acétylacétique, c’est la cétogénèse. Ce composé passe dans le sang où il est capté par différents organes qui, après l’avoir transformé en acétyl-CoA (acétylcoenzyme A), l’utilisent pour leurs besoins énergétiques. Les lipides sont donc les précurseurs de deux groupes d’aliments pour les cellules, les acides gras et l’acide acétylacétique;c ) L’acétyl-CoA est le précurseur de la synthèse des acides gras: la première réaction est une carboxylation qui le transforme en malonyl-CoA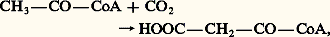 réaction qui consomme de l’énergie.d ) L’acétyl-CoA est le précurseur du cholestérol et par conséquent des hormones stéroïdes, des acides biliaires, de la vitamine D.La régulation est en grande partie hormonale. La lipolyse, qui libère les acides gras, est activée par l’adrénaline et le glucagon, alors que la synthèse des triglycérides est activée par l’insuline. Comme dans le métabolisme des glucides, ces hormones agissent en sens opposé, l’insuline favorisant les mises en réserve, l’adrénaline et le glucagon, la dégradation des réserves. La cétogenèse, synthèse d’acide acétylacétique à partir de l’acétyl-CoA, est activée par le glucagon, inhibée par l’insuline (fig. 9).L’acétyl-CoA-carboxylase, qui forme le malonyl-CoA, est la première enzyme de la synthèse des acides gras; c’est une enzyme allostérique qui est activée par l’acide citrique. Ce dernier, en s’accumulant, témoigne d’une charge énergétique élevée de la cellule, et il va favoriser la mise en réserve de l’énergie sous forme d’acides gras, puis de lipides. Un régime riche en glucides stimule la synthèse du complexe enzymatique qui permet la synthèse des acides gras et en particulier de l’acétyl-CoA-carboxylase, ce qui explique que ce type de régime augmente les réserves lipidiques.Nous avons vu qu’une hormone, le glucagon, favorise, dans le foie, la formation de glucose à partir de glycogène et à partir d’acide pyruvique; elle favorise la libération des acides gras des lipides et la formation de l’acide acétylacétique. Tous ces composés formés dans le foie (certains aussi dans les adipocytes) vont servir d’aliments à l’ensemble des cellules après passage dans le sang. Le glucagon est donc par excellence l’hormone qui sert de signal de faim cellulaire et qui va permettre de produire les aliments nécessaires aux cellules.Autres métabolismesBiosynthèse du cholestérolComme nous l’avons vu, le précurseur du cholestérol est l’acétyl-CoA. Ce composé subit un métabolisme complexe le transformant en acétoacétyl-CoA, puis en hydroxymétylglytaryl-CoA. Jusqu’à ce stade, le métabolisme est commun avec celui qui permet la formation des corps cétoniques. La première réaction spécifique est la réduction du dernier composé en acide mévalonique, réaction catalysée par une réductase. Cette réductase est soumise à régulation. En effet, si l’alimentation est riche en cholestérol, l’activité de l’enzyme baisse; en revanche, si l’alimentation est pauvre en cholestérol, l’activité de l’enzyme augmente et la synthèse endogène du cholestérol augmente également. Nous avons vu que la coordination entre la synthèse et l’apport exogène est assurée par le contrôle du recyclage des récepteurs qui fixent dans les cellules les lipoprotéines riches en cholestérol. Il semble que la régulation de la réductase se fait, d’une part, par le contrôle de la synthèse de l’enzyme, d’autre part, par la phosphorylation liée à la fixation du glucagon, l’enzyme active étant la forme non phosphorylée.Biosynthèse des nucléotides à purineLes nucléosides triphosphates sont les précurseurs du DNA et du RNA. Ces molécules sont synthétisées à partir de petites molécules; la première réaction spécifique, commune aux nucléosides à adénine et guanine, est catalysée par une amido-transférase. Cette enzyme est allostérique et inhibée par tous les produits terminaux de la réaction. De plus, la réaction qui forme l’AMP est inhibée par ce composé et ensuite celle qui forme le GMP est bloquée à son tour. En outre, la synthèse de l’AMP est activée par le GTP, de même que la synthèse du GMP est activée par l’ATP. Ainsi, grâce à ces enzymes allostériques, on observe: d’une part, une régulation qui empêche l’accumulation du GTP et de l’ATP (ce n’est que si ceux-ci sont incorporés dans les acides nucléiques que leur synthèse se poursuit), d’autre part, une coordination des synthèses, chacun de ces produits terminaux stimulant la synthèse de l’autre. Cela évite des synthèses à des taux très différents de ces précurseurs d’un même type de macromolécule.Biosynthèse de l’hèmeL’hème est un constituant de l’hémoglobine, des cytochromes (enzymes respiratoires). L’hème est une molécule polycyclique qui se synthétise à partir de glycocolle et de succinyl-CoA. La combinaison de ces deux précurseurs est catalysée par une enzyme appelée ALA-synthétase. L’hème, produit terminal de la suite des réactions, est à la fois un répresseur et un inhibiteur allostérique de l’ALA-synthétase. La synthèse de l’hème ne se poursuit que si ce composé s’incorpore dans les protéines.
réaction qui consomme de l’énergie.d ) L’acétyl-CoA est le précurseur du cholestérol et par conséquent des hormones stéroïdes, des acides biliaires, de la vitamine D.La régulation est en grande partie hormonale. La lipolyse, qui libère les acides gras, est activée par l’adrénaline et le glucagon, alors que la synthèse des triglycérides est activée par l’insuline. Comme dans le métabolisme des glucides, ces hormones agissent en sens opposé, l’insuline favorisant les mises en réserve, l’adrénaline et le glucagon, la dégradation des réserves. La cétogenèse, synthèse d’acide acétylacétique à partir de l’acétyl-CoA, est activée par le glucagon, inhibée par l’insuline (fig. 9).L’acétyl-CoA-carboxylase, qui forme le malonyl-CoA, est la première enzyme de la synthèse des acides gras; c’est une enzyme allostérique qui est activée par l’acide citrique. Ce dernier, en s’accumulant, témoigne d’une charge énergétique élevée de la cellule, et il va favoriser la mise en réserve de l’énergie sous forme d’acides gras, puis de lipides. Un régime riche en glucides stimule la synthèse du complexe enzymatique qui permet la synthèse des acides gras et en particulier de l’acétyl-CoA-carboxylase, ce qui explique que ce type de régime augmente les réserves lipidiques.Nous avons vu qu’une hormone, le glucagon, favorise, dans le foie, la formation de glucose à partir de glycogène et à partir d’acide pyruvique; elle favorise la libération des acides gras des lipides et la formation de l’acide acétylacétique. Tous ces composés formés dans le foie (certains aussi dans les adipocytes) vont servir d’aliments à l’ensemble des cellules après passage dans le sang. Le glucagon est donc par excellence l’hormone qui sert de signal de faim cellulaire et qui va permettre de produire les aliments nécessaires aux cellules.Autres métabolismesBiosynthèse du cholestérolComme nous l’avons vu, le précurseur du cholestérol est l’acétyl-CoA. Ce composé subit un métabolisme complexe le transformant en acétoacétyl-CoA, puis en hydroxymétylglytaryl-CoA. Jusqu’à ce stade, le métabolisme est commun avec celui qui permet la formation des corps cétoniques. La première réaction spécifique est la réduction du dernier composé en acide mévalonique, réaction catalysée par une réductase. Cette réductase est soumise à régulation. En effet, si l’alimentation est riche en cholestérol, l’activité de l’enzyme baisse; en revanche, si l’alimentation est pauvre en cholestérol, l’activité de l’enzyme augmente et la synthèse endogène du cholestérol augmente également. Nous avons vu que la coordination entre la synthèse et l’apport exogène est assurée par le contrôle du recyclage des récepteurs qui fixent dans les cellules les lipoprotéines riches en cholestérol. Il semble que la régulation de la réductase se fait, d’une part, par le contrôle de la synthèse de l’enzyme, d’autre part, par la phosphorylation liée à la fixation du glucagon, l’enzyme active étant la forme non phosphorylée.Biosynthèse des nucléotides à purineLes nucléosides triphosphates sont les précurseurs du DNA et du RNA. Ces molécules sont synthétisées à partir de petites molécules; la première réaction spécifique, commune aux nucléosides à adénine et guanine, est catalysée par une amido-transférase. Cette enzyme est allostérique et inhibée par tous les produits terminaux de la réaction. De plus, la réaction qui forme l’AMP est inhibée par ce composé et ensuite celle qui forme le GMP est bloquée à son tour. En outre, la synthèse de l’AMP est activée par le GTP, de même que la synthèse du GMP est activée par l’ATP. Ainsi, grâce à ces enzymes allostériques, on observe: d’une part, une régulation qui empêche l’accumulation du GTP et de l’ATP (ce n’est que si ceux-ci sont incorporés dans les acides nucléiques que leur synthèse se poursuit), d’autre part, une coordination des synthèses, chacun de ces produits terminaux stimulant la synthèse de l’autre. Cela évite des synthèses à des taux très différents de ces précurseurs d’un même type de macromolécule.Biosynthèse de l’hèmeL’hème est un constituant de l’hémoglobine, des cytochromes (enzymes respiratoires). L’hème est une molécule polycyclique qui se synthétise à partir de glycocolle et de succinyl-CoA. La combinaison de ces deux précurseurs est catalysée par une enzyme appelée ALA-synthétase. L’hème, produit terminal de la suite des réactions, est à la fois un répresseur et un inhibiteur allostérique de l’ALA-synthétase. La synthèse de l’hème ne se poursuit que si ce composé s’incorpore dans les protéines.
Encyclopédie Universelle. 2012.
